MEDICAL
2021.06.01
生体内における多様な細胞内分解現象のメカニズムを解明し、疾患の理解・治療への貢献を目指す

細胞生物学の分野では、「水晶体のすべてのオルガネラが分解されて透明になるメカニズム」が100年以上前から未解明のままでした。その謎を12年にわたる研究の末に解き明かし、2021年に筆頭著者・共同責任著者としてNature誌に報告したのが、生理学第二講座の森下英晃先生です。現在はその経験を活かして、生体内における多様な細胞内分解現象のメカニズムの解析に取り組んでいます。ゼブラフィッシュやマウスを使った選択的オートファジーについての研究は、文部科学省による科学研究費助成事業「基盤研究B」にも採択されています。そんな森下先生に、生理現象のメカニズムの解明にチャレンジすることの難しさや醍醐味などを伺いました。
医学部の学生のときに出会った「水晶体のオルガネラ全分解現象」に魅せられて
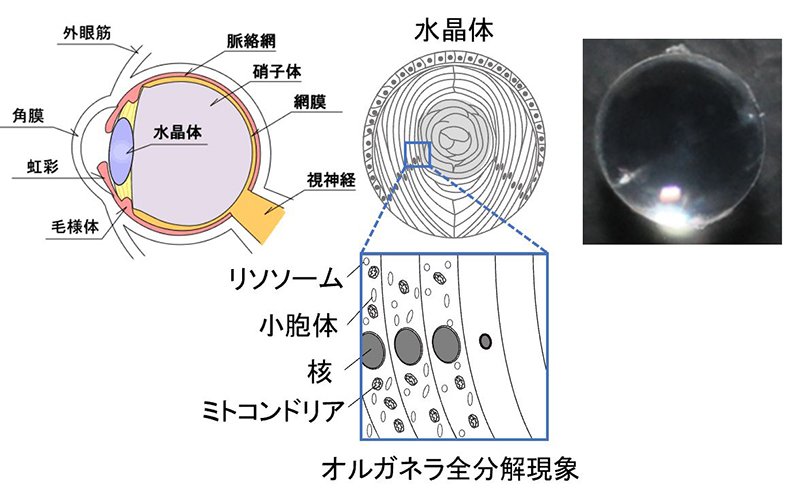
私たちヒトの体に存在する約30兆個の細胞の中には、ミトコンドリア、核などのオルガネラ(細胞小器官)が存在していて、それぞれに重要な役割を果たしています。そんなたくさんの細胞の中でも、眼の中にある「水晶体」という組織では細胞の中身が異なっています。水晶体の細胞には、すべてのオルガネラがないのです。

水晶体を構成する細胞ができる最初の段階では、ほかの細胞と同じようにオルガネラが存在しています。ところが、細胞が成熟していく過程ですべてのオルガネラが"分解"されて細胞膜だけが残った状態になります。このようにすべてのオルガネラがなくなることで、水晶体が透明なレンズとしての役割を獲得し、外界から入ってきた光を屈折させ、網膜に像を結んで「ものを見る」ことが可能になるのではないかと古くから考えられていました。
このユニークな生理現象について知ったのは、医学部の学生のときでした。当時参加した日本免疫学会の免疫サマースクール2003で、偶然、長田重一教授(大阪大学)の「水晶体の核DNAの分解に必要な酵素を発見した。ところが、ミトコンドリアなどの他のオルガネラはこのDNA分解酵素をノックアウトしてもどういうわけか正常に消える。その結果、核DNAだけが残った大腸菌のような細胞が出来上がる。」という発表を聞き、この謎に包まれた生理現象に大変興味を持ったのです。その後、臨床研修を経て大学院に進学するために水島昇教授(当時東京医科歯科大学、現東京大学)の研究室を見学した際に、この問題に取り組まれていることを知り、「この生理現象のメカニズムを知りたい」という強い好奇心から、「水晶体におけるオルガネラ全分解現象」を研究対象にすることを決めたのです。
オートファジーではない細胞内分解の可能性
細胞内のオルガネラを分解する細胞内分解の仕組みといえば、2016年のノーベル生理学・医学賞(大隅良典博士)の受賞対象となった「オートファジー(自食作用)」が知られています。オートファジーは、細胞内のタンパク質やオルガネラを取り込んで、分解し、再利用する仕組みです。細胞内で古くなったタンパク質やミトコンドリアなどがオートファゴソームの膜で取り囲まれたところに、分解酵素を含むリソソームが融合することで膜の内容物が分解されます。
当然ながら、当初は水晶体もオートファジーによるものだろうと考えられていました。そこで博士課程では、水晶体だけでオートファジー関連遺伝子をノックアウトしたマウスを作製したところ、このマウスはオートファジーが起きないために加齢に伴って水晶体が濁って白内障を発症するものの、オルガネラの分解は正常に起きることがわかりました。この研究から、水晶体にはオートファジーとは違う未知のオルガネラ分解機構が存在していることが確実になりました。
生きたまま細胞を観察できるゼブラフィッシュ
オートファジーによらないオルガネラ全分解現象に必要な因子の探索を進める中で、特に苦労したことが、候補因子の絞り込みでした。研究を始めてから4年間は、一般的なモデル動物であるマウスを使いましたが、マウスはコストが高く、できることが限られてしまいます。それでも10種類以上の候補因子のノックアウトマウスを作製しましたが、オルガネラの分解を止めることはできませんでした。
そこでマウスの次に選んだのはゼブラフィッシュでした。ゼブラフィッシュは名前の通り全身に縞模様がある体長3cmほどの小さな魚です。胚が透明なため卵から発生していくすべての過程を観察でき、タンパク質を蛍光タンパク質で光らせれば、生きた状態のままでその局在や動態を調べることもできます。加えて、2013年に開発されたCRISPR/Cas9というゲノム編集技術を用いることで、わずか数日で候補因子を簡易的にノックアウトできるなど、実験動物としてとても優れています。

そこで武田洋幸教授(東京大学)や川上浩一教授(国立遺伝学研究所)に教えていただきながら、研究室にゼブラフィッシュの飼育・実験系を自分で立ち上げた結果、生体内でのライブイメージングや候補因子のスクリーニングを簡単に実施できるようになりました。ところが、50種類以上の有力な候補因子を調べても水晶体のオルガネラ全分解に必須な因子を見つけることはできませんでした。
12年間の努力が実を結びNature誌に発表
マウスからゼブラフィッシュに切り替えてからも約4年間、研究スタートから見れば8年間もかかりましたが、ここで大きな転機を迎えます。大学院生と一緒に過去の実験データを見ているときに、ふと「水晶体のオルガネラ全分解の本質は膜分解なのではないか」(オルガネラ膜は屈折率が高いことが知られているので、水晶体を透明化するためには膜を壊すことこそが大切なのではないか)と思いついたのです。
それまではオートファジーによらない細胞内分解と思いつつも、どこかでオートファジーやリソソームに似た機構を想定していました。そこで、過去の定説や常識を一切取り払って、「膜そのものが分解されること」という視点で、オートファジーやリソソームとは関係のないさまざまな脂質分解酵素をノックアウトして調べてみました。すると、その当時新たな脂質分解酵素として注目され始めていたPLAATファミリー酵素が水晶体のオルガネラ全分解現象に必須であることが分かったのです。

この酵素は普段は細胞内のサイトゾル(細胞内のオルガネラを除いた細胞質基質と呼ばれる部分)の中にプカプカと浮かんでいてそのままでは膜を壊すことができませんが、ヒト遺伝性白内障の原因遺伝子産物Hsf4の働きによってオルガネラの膜がほんの少し損傷を受けるとはじめて膜に移行して膜分解を誘導できることもわかりました。つまり、この酵素は損傷オルガネラを「選択的」に認識して分解するのです。この酵素を持たないゼブラフィッシュやマウスはオルガネラが分解されないために先天性白内障になることもわかりました。
これらの一連の研究の結果、これまでに知られていないオートファジー非依存的オルガネラ分解機構の発見につながったことで、2021年4月にNature誌に筆頭著者、共同責任著者として発表することができました。PLAATファミリー酵素はさまざまな組織に発現していますので、水晶体以外の組織でも、損傷オルガネラが関連するさまざまな現象に関わっているのではないかと考えています。一方、水晶体の研究過程で作製した多くのオートファジー関連因子ノックアウト動物も並行して解析した結果、各種臓器におけるオートファジー関連因子の新たな生理機能や関連疾患(新生児呼吸窮迫症候群、脂質代謝異常症など)の同定につながりました。このように長年にわたり研究を継続できる環境を与えていただいた水島昇教授、多くの関係者の方々、そして論文化にあたりサポートいただいた現所属研究室の小松雅明教授に深く感謝しています。
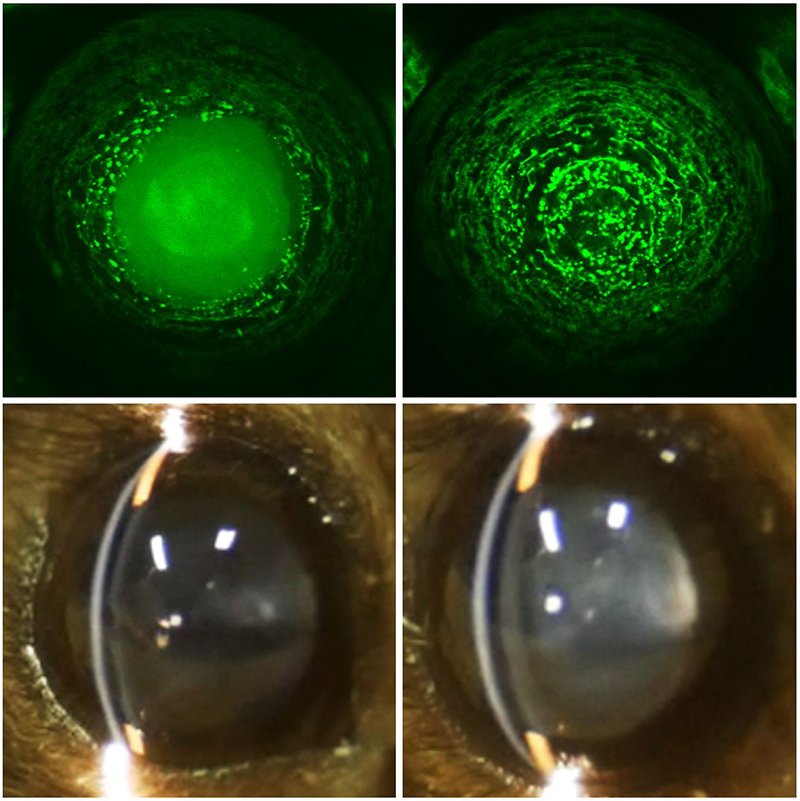
正常な水晶体(左側)とPLAATファミリー酵素を欠損させた水晶体(右側)。上段はゼブラフィッシュの小胞体内腔タンパク質のライブイメージング像、下段はマウスのスリットランプ像(Morishita et al., Nature, 592: 634-638, 2021より引用改変)。
生体内における選択的オートファジーの役割の解明へ
水晶体の研究ではオートファジーによらない細胞内分解に特に着目しましたが、オートファジーによる細胞内分解にもまだまだ未解明な課題がたくさんあります。そのひとつが、近年世界中で活発に研究されている「選択的オートファジー」です。当初オートファジーは無作為にタンパク質を分解する非選択的な現象だと考えられていましたが、その後の研究により、異常なミトコンドリアやユビキチンが結合したタンパク質などは選択的に分解されることがわかりました。
選択的オートファジーは、細胞の品質管理や恒常性維持に関わる重要な現象で、神経変性疾患、腫瘍などのさまざまな疾患発症の原因であるといわれています。そのような疾患の病態解明や治療法開発のためにも、多くの不明な点が残っている生体内における選択的オートファジーのメカニズムや意義を明らかにすることが不可欠です。

現所属研究室の小松雅明教授は、選択的オートファジーの研究における第一人者です。順天堂大学内には特徴的なオートファジー研究で成果を上げている研究者が多く活躍されており、共同研究設備も充実しています。現在、ゼブラフィッシュに関しては、難治性疾患診断・治療学(岡﨑康司教授)の飼育設備の一部を使わせていただき実験を行っています。そのような大変恵まれた環境の中で、ゼブラフィッシュやマウスを用いた生体内解析という自分なりの強みを活かして、生体内のさまざまな細胞内分解現象における選択的オートファジーの役割や、ユビキチン・プロテアソーム系、PLAATファミリー酵素などの他の選択的分解機構の関与の有無を解き明かすことが今の私の目標です。
基礎医学研究を通じて、疾患の理解・治療への貢献を目指す
私は医学部の学生の時に基礎医学の研究室に出入りさせていただき、基礎医学研究の意義を教えていただきました。その後、臨床研修で難治性疾患に苦しむ患者さんを担当した経験から、「基礎的な研究を通じて難治性疾患の理解や治療に貢献したい」という志を抱き、基礎医学研究の道に進みました。生命現象の基本原理を解明することができれば、そこからさまざまな疾患の発症メカニズムの理解が深まり、新たな予防・治療法の開発へとつながります。そして、その原理が普遍的であるほど裾野が広く、治療への可能性も広がるのだと考えています。自分の携わった研究の成果が将来の医学の発展に少しでも貢献できるよう、今後も日々努力していきたいと思います。

森下 英晃(もりした・ひであき)
順天堂大学医学部生理学第二講座講師
2007年、九州大学医学部卒業。2009年、国立国際医療研究センター臨床研修修了(内科コース)。2013年、東京医科歯科大学大学院博士課程修了(医学博士)。同年より東京大学大学院医学系研究科特任研究員、助教を経て、2019年より現職。2017年から2020年はERATO「水島細胞内分解ダイナミクスプロジェクト」生理機能解析グループリーダーも務めた。主な研究テーマは、オートファジー依存的・非依存的経路による細胞内分解のメカニズム、意義、疾患との関連の解明。日本細胞生物学会大会若手優秀発表賞(2020年)、日本白内障学会学術賞(2021年)などを受賞。現在、第31回日本医学会総会の学術委員を務めている。



