MEDICAL
2022.09.28
オートファジー研究の最前線―選択的オートファジー研究が拓く 複雑な生命現象と疾患の関わり
2016年に大隅良典博士がノーベル生理学・医学賞を受賞したことで広く知られることになったオートファジー。当初は、無作為にタンパク質を分解する生命現象だと考えられていましたが、今は特定のタンパク質やオルガネラ(細胞内小器官)を狙って分解する「選択的オートファジー」の存在が明らかになっています。それまでのオートファジー観を大きく変えるきっかけとなった「条件付きオートファジー欠損マウス」を世界に先駆けて作り出し、現在に至るまで選択的オートファジー研究でトップを走り続ける小松雅明先生に、オートファジー研究の今とこれからについて聞きました。
「究極の生存戦略」としてのオートファジー
-
――オートファジー研究はどのように発展してきたのでしょうか。
オートファジー研究は、1990年代に大隅良典先生がオートファジー関連遺伝子(ATG遺伝子)を同定したことで大きく進展しましたが、その現象についてはかなり古くからわかっていました。
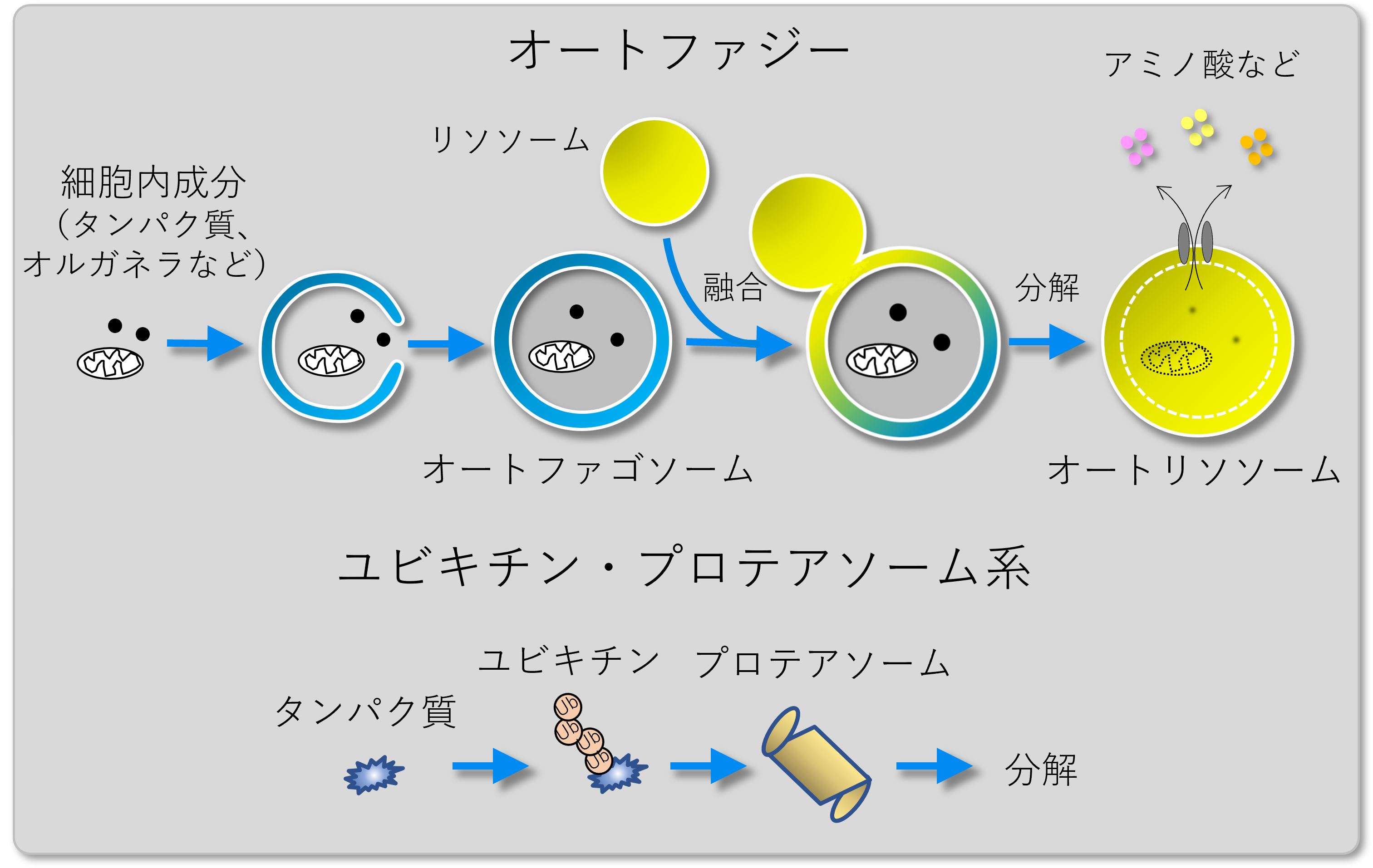
オートファジーとは、生体内で合成された自己タンパク質を分解処理する「自食作用」で、オルガネラ(細胞内小器官)を含む細胞の成分を包む膜が現れてオートファゴソームを形成し、さらにリソソームと融合することでその中の細胞成分が分解されます。このリソソームを1950年代後半に生化学的な手法で同定したのが、ベルギーの生化学者クリスチャン・ド・デューブ博士でした。その数年後には、ロックフェラー大学のキース・ロバーツ・ポーター博士とトーマス・アシュホード博士によって電子顕微鏡観察でオートファゴソームが見出されました。これらの研究がオートファジー研究の始まりだといえます。
この頃から電子顕微鏡技術の向上によって細胞内のクリアな構造が見えるようになり、オートファジーという現象を形態学的に捉えることが可能になりました。しかし、それから約30年間、オートファジー研究はほとんど進展がないままでした。そんな状況を30年ぶりに打破したのが大隅先生です。出芽酵母にもオートファジーが存在することを示し、そしてオートファジーに必須のATG遺伝子群の同定に成功したのです。そこから、分子機構や生理機能などが次々と明らかになりました。
――生命現象としてのオートファジーの働きが解明されたのはいつ頃でしょうか。
オートファジーという現象が栄養飢餓になると著しく誘導されるということは、1960年代にはわかっていました。2000年代にはATG遺伝子を欠失させた動物モデルが開発され、基本的なオートファジーの働きが明らかにされました。例えば、出産直後に胎盤からの栄養が絶たれたときや絶食などで栄養飢餓状態になったとき、細胞の中のタンパク質を壊してアミノ酸を作り出してエネルギーにする、「究極の生存戦略」という言葉が相応しい現象が起こります。さらに、栄養が十分にある状態でも常に弱いレベルでオートファジーが働き、細胞内の新陳代謝を行う「恒常性維持」という機能も担っていることがわかっていきます。
この「究極の生存戦略」「恒常性維持」として機能するオートファジーは、対象を選ばず、ランダムにオートファゴソームで包んで分解すると考えられてきました。ところが、オートファジーが起こらなかった細胞の中には特定の異常なタンパク質やオルガネラが蓄積していって、さまざまな病気の原因になっていることが判明しました。従来考えられていたようなランダムな分解ではなく、変性タンパク質や異常オルガネラを狙って分解する「選択性」があることがわかってきたということです。

オートファジーに「選択性」があることが判明
――従来の知見とは異なる「選択的オートファジー」において、小松先生の研究が重要な役割を果たしているそうですね。
大隅先生の発見以降、ATG遺伝子を欠損させたノックアウトマウスが作られ、多くの機能解明に役立ちました。しかし、全身性のオートファジーノックアウトマウスは生後1日以内で死んでしまうため、大人になってからの解析が難しいという問題がありました。
そこで私たちは、臓器ごとにオートファジー関連遺伝子のひとつであるATG7を欠損させることができる「条件付きオートファジー欠損マウス」を、2005年に世界に先駆けて作り出しました。このマウスを用いて、脳、肝臓、膵β細胞だけというように臓器や細胞別にオートファジーとの関わりを調べ、オートファジーの抑制がさまざまな疾患の原因になっていることがわかったのです。
――選択的オートファジーと疾患の関わりでは、どのようなことがわかっているのでしょうか。
オートファジーと関連の深い疾患として、もっとも顕著なのが神経変性疾患です。パーキンソン病の原因遺伝子であるParkinとPINK1は、傷ついたミトコンドリアや異常なミトコンドリアを分解するオートファジー(マイトファジー)を起こし、ミトコンドリアの品質管理をしています。しかし、マイトファジーが働かなくなることで不良・異常ミトコンドリアが蓄積されてパーキンソン病を引き起こすことがわかっています。
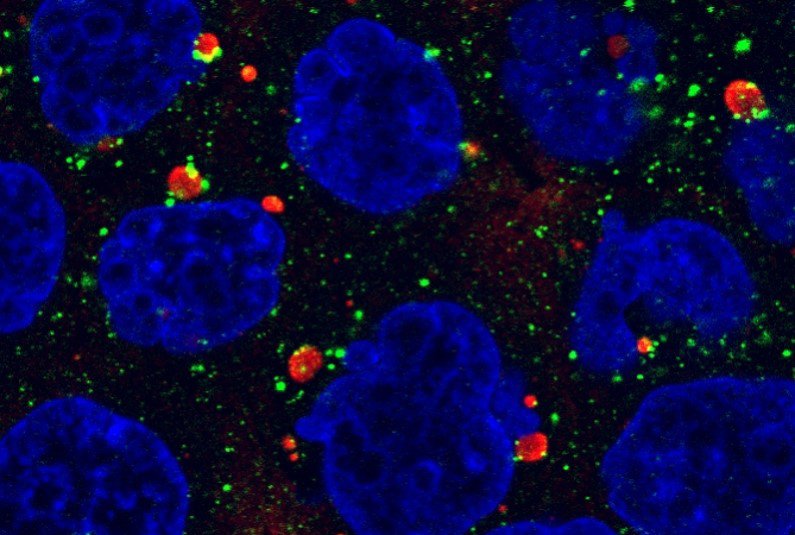
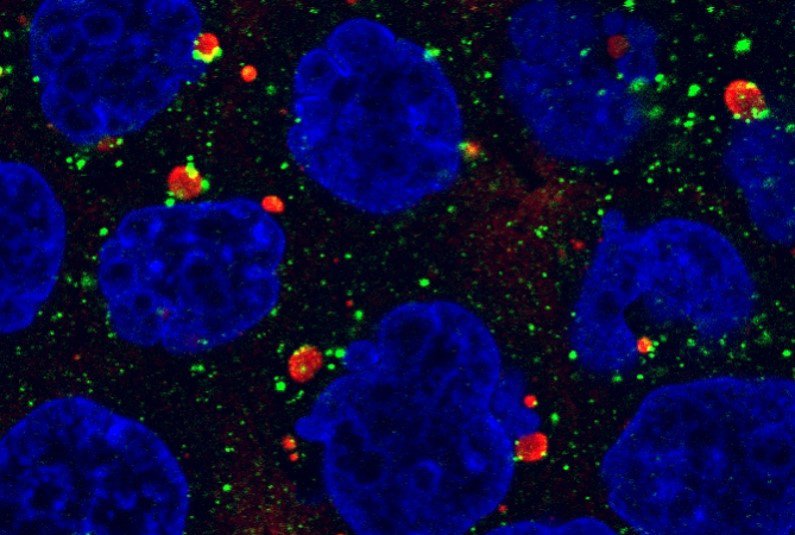
私たちが研究対象としているp62という細胞内タンパク質はオートファジーの選択性に関わる重要な分子で、p62をコードする遺伝子に変異があると、神経難病として知られるALS(筋萎縮性側索硬化症)やFTLD(前頭側頭葉変性症)を起こします。ほかにもオートファジー関連遺伝子の変異によって、SENDA病やVici症候群といった重篤な神経変性疾患が起こることがわかっています。
最近の研究では、「究極の生存戦略」と「恒常性の維持」という基本的な生理機能のほかに、幹細胞の維持機構や老化制御、環境応答、分化などにも働いていることがわかってきています。そういうことはオートファジーの基本的生理作用だけでは説明がつかず、選択的オートファジーを理解することが不可欠です。選択的オートファジー研究は、新たな生命機能を見つけるうえでも大変重要だと考えています。
ユビキチン化がオートファジーにも作用
――では、どのようにしてオートファジーの対象を選択しているのでしょうか。
哺乳動物での選択性の可能性について言及されたのは2005年のことでした。ノルウェーの研究者が行った細胞レベルの研究で、変性しユビキチン化されたタンパク質からなる凝集体がp62によりオートファゴソームに運ばれることが提唱されました。私たちは同年にATG7を欠損させた肝細胞に、2006年にはATG7を欠損させた神経細胞にユビキチン化タンパク質凝集体が蓄積し、それぞれ肝障害、神経変性疾患を引き起こすことを見出しました。2007年には、オートファジー不能肝細胞や神経細胞に蓄積するユビキチン化タンパク質凝集体形成にp62が必要であることをマウスの解析により発表しています。
ユビキチンは標的とするタンパク質に結合して、そのタンパク質を分解するときの目印となります。その目印を頼りにプロテアソームという酵素複合体がやってきてタンパク質を分解するのが、ユビキチン-プロテアソーム系という分解システムです。このようにユビキチンという明確な目印があるユビキチン-プロテアソーム系と、ランダムに細胞質成分を分解すると考えられてきたオートファジーは、長らく別の仕組みだとされてきました。
ところが、まったく別物と考えられてきたユビキチンが、選択的オートファジーにおいても分解されるための目印として働いていたのです。これはかなり面白い発見です。
――ユビキチン化がプロテアソームに向かうか、オートファジーに向かうか、どうやって選択しているのでしょうか。
同じユビキチン化を利用しながらどうやってプロテアソームとオートファジーを分けているのかという謎は、世界中の研究者が今まさに挑んでいる最先端のサイエンスです。
現時点でわかっていることは、分解するタンパク質のサイズが大きい場合はオートファジーに向かわせているらしいということです。オルガネラなどの巨大なものは、細い筒状の穴を通してその内腔内にあるプロテアーゼで分解するプロテアソームでは壊すことができません。一方、オートファゴソームは直径約1マイクロメートルもある球状で、普通のサイズのタンパク質を10万から100万個と取り囲むことができる巨大な構造体です。
とはいえ、単純に大きさだけで分けているわけではありません。同じユビキチン化タンパク質というシグナルを認識していても、プロテアソームとオートファジーとに道が分かれることがあり、それはまだ完全にはわかっていません。
臨床の視点が加わりメカニズム解明が加速
――順天堂大学におけるオートファジー研究はどのように発展してきたのでしょうか。
本学におけるオートファジー研究の源流は、私の大学院時代の指導教官でもある木南英紀先生(現学長特別補佐)です。木南先生はもともとリソソーム酵素の研究がご専門で、大隅先生とも共同研究をされていたご縁で私もオートファジー研究をすることになり、ノックアウトマウスを作製しました。木南研究室では上野隆先生(現客員教授)も、オートファジーの生化学的研究の基礎を支えた方です。また、内山安男先生(現老人性疾患病態・治療研究センター長)は形態学的なアプローチで本学のオートファジー研究を推進されたおひとりです。
条件付きオートファジー欠損マウスができると、臨床との共同研究も活発になりました。例えば、糖尿病・内分泌内科の綿田裕孝教授との共同研究では、インスリン分泌を司る膵β細胞で特異的オートファジー欠損マウスを作り、膵β細胞におけるオートファジーの重要性を短期間に明らかにすることができました。神経変性疾患についても多くの発見がありましたし、肝臓におけるオートファジーの異常が肝疾患や肝腫瘍を起こす仕組みなどもわかっています。最近では、オートファジーを利用したアトピー性皮膚炎の治療法開発に向けた研究なども進んでいます。

≪関連記事≫
「順天堂大学が取り組む糖尿病の病態解明の現状とは?」
https://goodhealth.juntendo.ac.jp/medical/000123.html
≪プレスリリース≫
「アトピー性皮膚炎の炎症を軽減する抗菌ペプチドを確認
―オートファジーを利用したアトピー性皮膚炎の治療法開発に向けて―」
https://www.juntendo.ac.jp/news/20220906-03.html
――基礎と臨床が連携することで、どんな相乗効果がありますか。
臨床の先生が私たちの作製したノックアウトマウスを用いて専門的な実験をすることで、基礎研究だけではわからなかったことが色々とわかるようになっています。各臓器におけるオートファジーの本当の重要性を知ることもできました。
マウスを使った基礎研究とは違って、ヒトのデータを扱うことで新たに見えることもあります。例えばヒトの疾患で変異が見つかれば、その変異から細胞機能やオートファジーの異常を見つけることもできます。
新たなオートファジーの仕組みを見出すために
――世界中のオートファジー研究者が集う機会があると伺いました。
2022年10月に北海道で開催される「第10回オートファジーに関する国際会議」で私が組織委員長を務めることになっていまして、順天堂大学にも多大な支援をしていただいています。この会は1997年に大隅先生が立ち上げたもので、世界中のオートファジー研究者が一堂に会し、分子から病態まで幅広く議論します。今回は久しぶりに対面でのミーティングとなり、海外からも研究者たちがやってきます。特に若い研究者たちにとって、良い交流の場になればと思っています。
――今先生がもっとも注力している研究を教えてください。
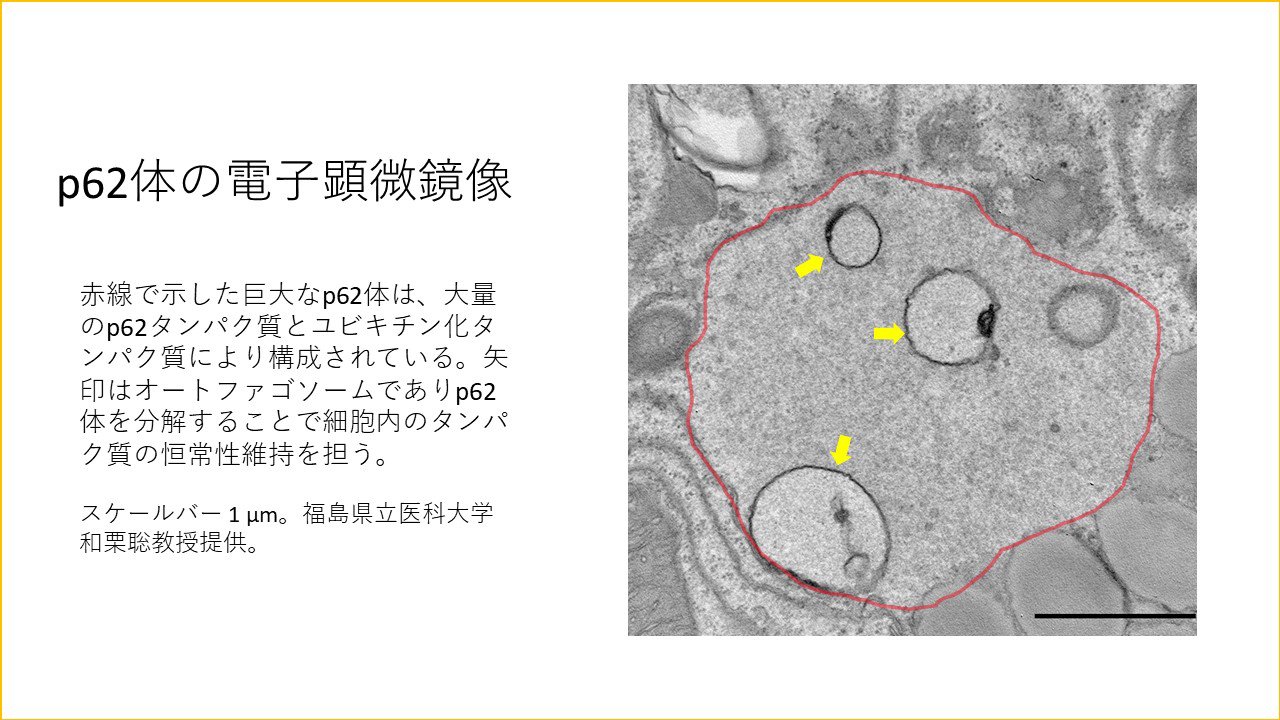
以前からずっと取り組んでいるp62のことを、さらに突き詰めていきます。p62はユビキチン化タンパク質と結合すると、細胞内でp62体と呼ばれる巨大な構造体を形成することがわかっています。オートファジー不全マウスやALSやFTLDといった神経変性疾患や肝細胞癌患者組織において異常なp62体が大量に蓄積することが知られています。今後は、p62体の形成、生物学的意義、分解、そして病態発症機構との関連を明らかにしたいと考えています。
もう一つ、ユビキチン同様にタンパク質に結合するUFM1(ユビキチン様タンパク修飾系)システムについても研究を進めているところです。私たちは世界に先駆けて、UFM1システムが赤血球分化や神経発生に不可欠であること、UFM1システムを構成するタンパク質をコードする遺伝子の変異が遺伝性小児脳症をきたすことなどを発見しています。当初UFM1はオートファジーとは直接関与しないだろうと考えられていましたが、調べていくうちに、小胞体を食べるオートファジー(ERファジー)や、リボソームのオートファジー(リボファジー)などの選択的オートファジーに関わるという可能性が見えてきました。
――今後、ご自身の研究をどのように発展させていきたいですか。
大隅先生は、基本的な生理機能としてのオートファジーの仕組みが60%くらいわかったと言われていますが、選択的オートファジーについてわかっていることはそれよりもかなり少ないはずです。加えて、選択的オートファジーを調べるほどに、ミトコンドリアや小胞体、UFM1など次々と新たな課題が立ち上がってきますから、長年取り組んできたp62を中心に、そのメカニズムを明らかにしたいと思っています。



