PICK UP!
2020.03.13
新たなバイオマーカーが子宮体がん手術を変える!臨床医の願い(ニーズ)と基礎研究(シーズ)の出会いがイノベーションを生む【順天堂×理研の共同プロジェクト】

順天堂大学と理化学研究所との共同研究プロジェクトにより画期的な医療技術・イノベーションが生まれつつあります。本日はこのプロジェクトに長年携わってこられた順天堂大学医学部の寺尾泰久先任准教授と吉田惠美子助教、国立研究開発法人理化学研究所(以下、理研)の伊藤昌可博士・コーディネーターに研究の道のりと今後の展開についてお伺いしました。 順天堂と理化学研究所との間で包括的基本協定が締結されたのは、2012年4月のこと。本協定に基づく共同研究では、当初から各種がんをターゲットに診断バイオマーカー(判定に使える遺伝子)を見いだし、よりよい治療につなげることを目標にしてきました。その成果のひとつが、2017年10月に発表した「子宮体がんの原発巣(がんの始まりの病巣)の遺伝子からリンパ節転移を見分けるバイオマーカーの発見」です。
過剰なリンパ節切除を減らすために
子宮体がんとリンパ節切除の現状
まずは研究の概要について教えてください。
寺尾: 子宮体がんは、近年卵巣がんや子宮頸がんを抜き、婦人科がんの中でもっとも患者数が多いがんとなっています。子宮体がんの治療は原則手術によって行います。手術ではがんの病巣がある子宮を取り除くのですが、周辺にあるリンパ節への転移が心配されるため、同時にリンパ節切除も行うことが一般的です。しかし、リンパ節を切除することで術後に足のリンパの流れが滞り、リンパ浮腫と呼ばれるむくみ等をきたすことがあります。この結果、身体的・精神的負担をはじめ日常生活に大きな支障が生じてしまうという方が少なくありません。リンパ節切除は、がんの広がりや進行の程度を診断する上で必要な処置である一方で、結果的に切除したリンパ節組織にがん転移が見られなかった方も多くいらっしゃるのが現実です。

医学部産婦人科学講座 寺尾泰久先任准教授
吉田: "リンパ浮腫によって術後に日常生活が大きく変わってしまった患者さんがいる"という現実がこの研究を進める大きな動機となりました。過剰なリンパ節切除を減らしたい、患者さんの負担をすこしでも軽減したい、という"臨床医の強い願い"からこの研究はスタートしました。
リンパ節を切除すれば手術自体の負担も増えますし、傷が大きくなって出血量が増える可能性もあります。さらに術後にリンパ浮腫を発症すれば、治療のための時間も必要になりますし、運動制限により外出も難しくなったり服装の自由も制限されてしまいますし、場合によっては、就業機会が失われることも少なくありません。まだまだ働き盛りの女性に発症する子宮体がんは、社会や家庭において多彩な役割を担う女性の生活に様々な影響を及ぼし、生活の質を下げる原因になる可能性があります。
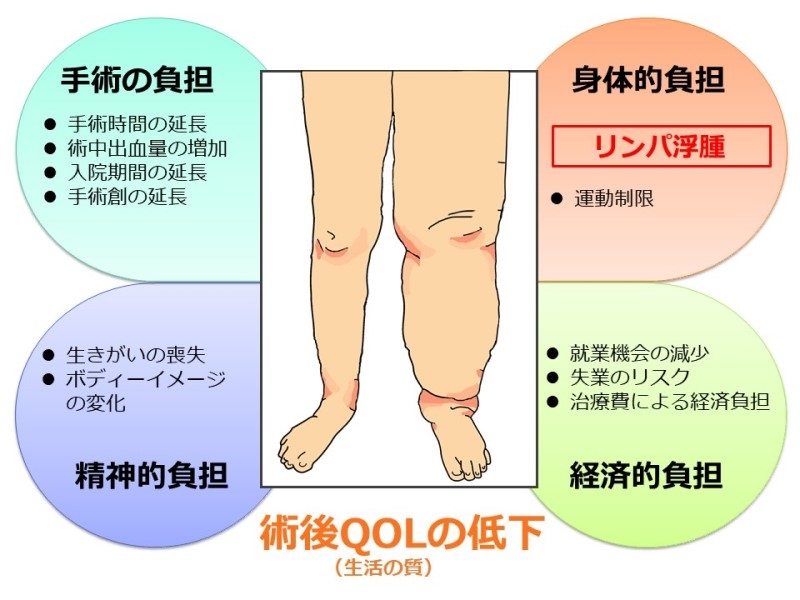
リンパ節切除によって生じる様々な負担
子宮体がん自体は比較的予後の良いがんの一つですが、がんは治ったのに治療の合併症で術後の生活が制限されてしまうのは、臨床医として、同じ女性として非常に胸の痛むところです。 そこで多くの負担や合併症の原因となりうるリンパ節切除について、「個別にリンパ節切除の必要性を精度よく判定できるバイオマーカーはないだろうか」と考えたのが、この研究の最初のきっかけです。「患者さんの生活の質(QOL)を上げたい」という、私たち臨床医の臨床的発想から始まった研究ともいえます。

医学部産婦人科学講座 吉田惠美子助教(中央)
従来のリンパ節転移診断の"限界"
寺尾: がんのリンパ節転移の診断方法は、腫瘍マーカー、PET・CT・MRIによる画像診断などがありますが、それぞれに課題を抱えています。例えば、臨床で一般的に用いられている腫瘍マーカーは、たんぱく質や酵素などのがんから産生される特徴的な物質を測定する方法ですが、がんの有る無しのスクリーニングには適していても、リンパ節転移を正確に判定するのはまだまだ困難です。リンパ節転移があるのに陰性と判定してしまったり、その逆も起こります。画像診断も同様で、読影する条件により差がでることもあります。
現状ではリンパ節転移診断においてもっとも有用なのは、乳がんなどで臨床応用されているセンチネルリンパ節診断です。リンパ節転移において、がんができた臓器から最初に拡がっていくリンパ節の領域を所属リンパ節といい、そのうち原発巣から一番最初にがんが転移するリンパ節をセンチネルリンパ節といいます。このセンチネルリンパ節を見つけて摘出し、がん細胞があるかどうかを調べる方法がセンチネルリンパ節診断です。センチネルリンパ節にがん細胞が無ければ、がんは原発巣に留まっていて原発巣より外に拡がっていないと診断され、転移のないリンパ節は切除されません。

乳がんの診断ではがんがある方の乳房の周辺だけを調べればよいのですが、子宮体がんの場合は子宮が体の中央にあるため子宮の両側に存在するリンパ管の流れをどちらも調べなければなりません。さらに、所属リンパ節も骨盤内からみぞおちまでのとても広い範囲に拡がっています。また、子宮の近くの骨盤内の所属リンパ節をスキップして遠い傍大動脈周囲の所属リンパ節に直接転移する場合もあります。このため、条件によっては診断範囲が不十分になっているケースもあります。また、このセンチネルリンパ節診断では検査のための色素や放射性同位体を注射したりレントゲン撮影をしますので、患者さんの負担が増えますし、臨床医の作業も非常に煩雑です。
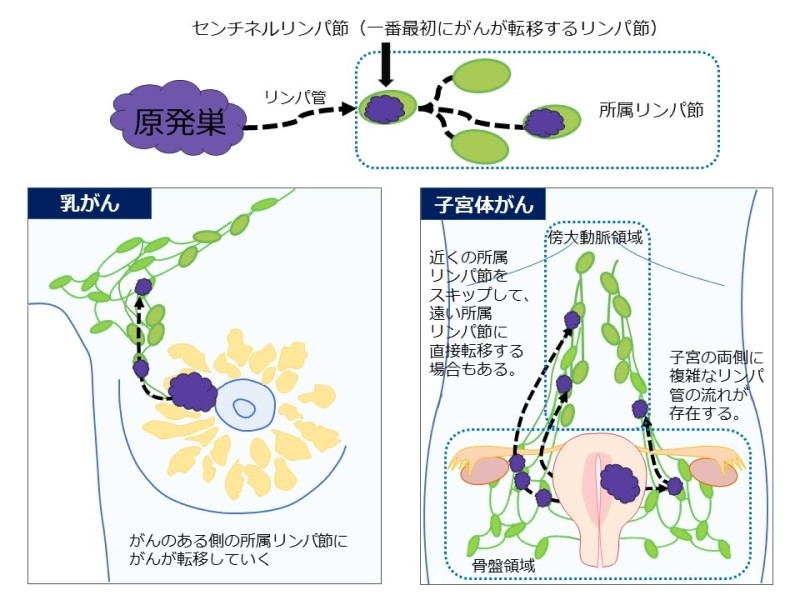
センチネルリンパ節診断の概念図(乳がんと子宮体がんの比較)
そこで「リンパ節転移の有無を精度良く迅速に診断できるバイオマーカーを確立できないか?」、そう考えていたときに理化学研究所との包括的基本協定が締結され、理研がもつ"基礎研究のノウハウ"と私たちの"臨床医の願い"が合致して理研との共同研究がスタートしました。
理研との共同研究で新たな診断法の開発へ
手術中にリンパ節転移の有無を診断するバイオマーカーの探索
どのように研究を進めましたか?
吉田: 本プロジェクトで目指すのは、誰でもどこの施設でも実施可能な、安全なリンパ節転移診断法の開発です。
現状の子宮体がん手術では、リンパ節転移が有っても無くても標準的に同じ手術がされています。なぜなら、現在の臨床では手術で切除したリンパ節にがんが有るか無いかを調べる方法でしかリンパ節転移診断を確定する方法がないからです。結果的には切除された多くのリンパ節にはがんの転移がありません。しかし稀にではあってもリンパ節転移は起こるので、少ないリンパ節転移陽性を見逃さないために標準的にリンパ節切除が画一的に実施されています。このため、大きな術後負担が生じています。
そこで私たち研究班は、リンパ節切除を行う直前に、手術で摘出した子宮から子宮体がんの組織を採取しその遺伝子を調べることで、リンパ節転移の有無を手術中に診断し、リンパ節切除を実施するかどうかをその場で決定する迅速術中診断法の開発を目指しています。つまり、手術中の診断結果で、リンパ節転移が有る場合はリンパ節切除を行い、無い場合はリンパ節切除を行わず負担の少ない手術を目指そうと考えています。この診断法で最も重要となるのがリンパ節転移を見分ける指標となるバイオマーカーを見つけることです。
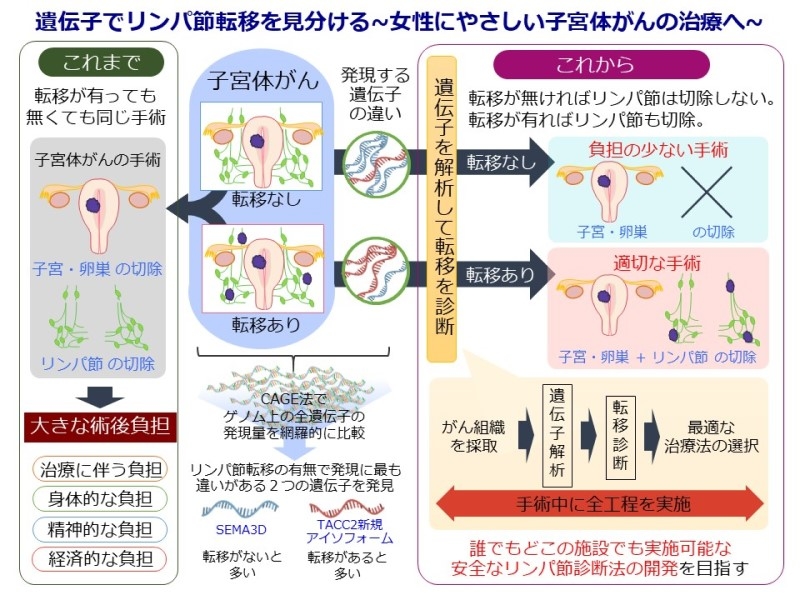
共同研究プロジェクトの全体像
まず、私たちは「子宮体がんの原発巣において、リンパ節転移の有るがんと無いがんを比べたとき、発現している遺伝子に差があるのではないか」と仮説をたてました。リンパ節転移の有るがんと無いがんとの間で発現に大きく違いがある遺伝子があれば、その遺伝子はリンパ節転移を診断するバイオマーカーになる可能性があるといえます。では、膨大に存在する遺伝子の中から、バイオマーカー候補となる遺伝子をどのように抽出すれば良いのでしょうか?理想としては全部の遺伝子を"すみからすみまで"網羅的に調べることができれば、最も良いバイオマーカーを探すことができます。そして、ヒトの遺伝情報であるゲノムにおける全ての遺伝子発現量を調べられる唯一の方法が、理研が独自に研究開発したCAGE(Cap Analysis of Gene Expression)法という遺伝子発現解析技術でした。
寺尾: 私たち研究チームのコアメンバーである理研の伊藤先生は、CAGE法の生みの親ともいうべき存在です。CAGE法なしにはこの研究はありえませんでした。
理研が独自で開発した<CAGE法>とは?
伊藤: CAGE法をごく簡単に説明すると、DNAから転写されるRNAの発現量を測定することで、遺伝子の活性化状態を定量的に解析するものです。人のゲノム全体をすみずみまで見て、それぞれのDNAにある遺伝子の発現量を数値で表せる画期的な手法です。

理化学研究所 伊藤昌可博士・コーディネーター
ヒトゲノムプロジェクト(ヒトゲノムの全塩基配列を解析する世界的プロジェクト)が進む中で、私たち理研はRNAをメインターゲットにしました。実はDNAの配列を読むだけでは情報が不足していて、本当に必要な情報を知るにはRNAの情報をすべて集めなくてはなりません。遺伝子は細胞の形や体の様々な作用などを担うタンパク質の設計図です。遺伝子が働くためには、その設計図(DNA)の情報が必要に応じて読み取られ、設計図を元に正確にRNAが作られる必要があり、これを転写といいます。活発に働いている遺伝子は転写が活性化して、作られるRNAも多くなり、結果として遺伝子が持つ様々な働きが体の中で変化します。つまり、遺伝子がどのくらい活発に働いているかを知るためには、設計図(DNA)の情報ではなく、転写によってどれくらいのRNAが作られているかの情報を知る必要があるわけです。ただし、RNAはとても不安定で、組織や細胞から採取するとすぐに分解されてしまうものがほとんど。そこで、分解されていないRNAに着目し、補足する技術がCAGE法の基本原理です。
吉田: 私たちはCAGE法による網羅的解析で選び出された候補遺伝子の発現を詳しく検討することで、最も診断の精度が高い遺伝子として「SEMA3D遺伝子」と「TACC2新規アイソフォーム(以降TACC2)遺伝子」の2つを同定しました。リンパ節転移が有るがんでは、SEMA3Dの発現量が低く、反対にTACC2の発現量は高くなる傾向があることが明らかになりました。このSEMA3D遺伝子とTACC2遺伝子の発現量を組み合わせることが最も精度の高いバイオマーカーになるのではないかと考えました。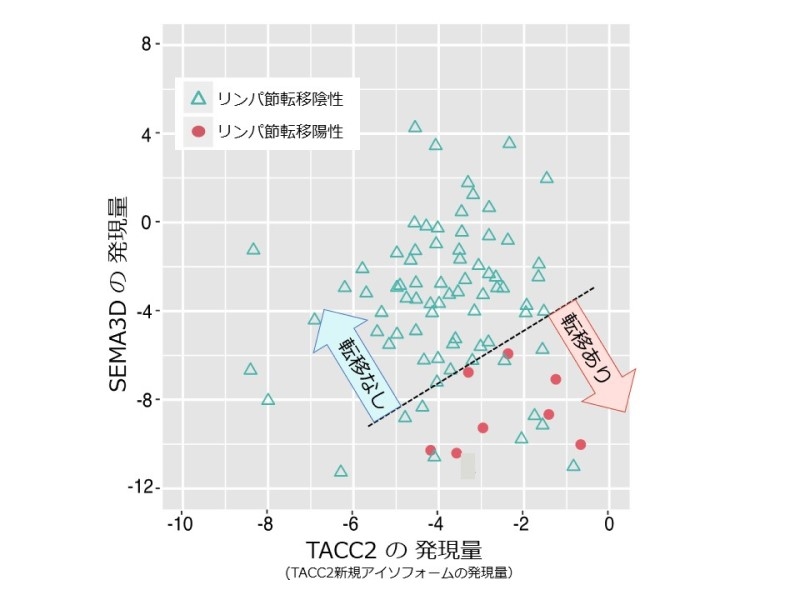
SEMA3D・TACC2新規アイソフォームとリンパ節転移の関係
新たな診断法の臨床応用実現に向けての挑戦
寺尾: 私たちは、この2つのマーカー遺伝子の組み合わせで子宮体がんの手術中にリンパ節切除の必要性を診断できるようにしたいと考えています。具体的には、手術で取り出した子宮から、がん組織を3か所採取し、私たちが見つけた2つのマーカー遺伝子を定量することで転移の有る無しを診断します。そして転移が無いと診断した場合はリンパ節切除を行わず、転移が有ると診断された場合は徹底的にリンパ節を切除します。手術ではがんのある子宮自体を摘出するのは必須です。私たちの方法は、手術で摘出した子宮からがん組織を採取しバイオマーカーの発現量を調べるわけですから、患者さんへの負担は一切増えません。このようにリンパ節ではなく、子宮体がんのがん組織の中のバイオマーカー遺伝子を定量してリンパ節への転移の有無を診断する手法は、オリジナリティのあるアプローチ方法です。
ただし、これを実現するためには大きな技術革新が必要です。
吉田: がんなどの固形組織の遺伝子発現量を定量するには、現状ではどうしても2~3時間程度かかります。しかし臨床応用するのであれば手術中に"リンパ節切除の必要性の有無"を判断しなくてはなりませんから、一連の工程、つまりがん組織の採取から定量結果に基づく診断までを30分程度にまで短縮したいと考えています。

寺尾: 患者さんから取り出したがん組織は固体ですので、これを液状化して遺伝子を抽出し高精度に定量化する。これを30分以内でやりとげようと、今、伊藤先生はじめ理研の先生方を中心として技術開発を行っていますが、いちばんの難所ですね。
伊藤: 現在、30分に短縮することを目標に鋭意開発中です。等温核酸増幅法(スマートアンプ法) という技術なのですが、本研究の共同研究者である理研の臼井健悟開発ユニットリーダーと別のプロジェクトで診断キットを作っていたので、その技術の応用を考えています。それまでは液体に近いサンプルばかりでしたが、子宮体がんのがん組織は固体で、ものによってはブヨブヨだったりガチガチだったりします。どこまで対応できるか、私たちもチャレンジしてみたいと思います。
臨床医の願い(ニーズ)と基礎研究(シーズ)の出会いがイノベーションを生む
研究中のご苦労は?
寺尾: 一番は診断速度をあげることと診断精度を確認することですね。先ほどお話した遺伝子発現量を測定する時間を2~3時間から30分に短縮する技術的なハードルと、バイオマーカーが本当に高い診断精度を持っているかを確かめることです。精度を確かめるためには多数の組織検体を集めて様々なパターンの子宮体がんにおいてバイオマーカーが正しく診断できるか確かめる必要があります。リンパ節転移陽性症例はあまり多くないため、順天堂だけでなく、国立がん研究センター・神奈川県立がんセンター・日本医科大学などにもご協力をいただき検体を集めています。必要とする組織検体数が早く集まれば、検証までの時間が短縮でき、患者さんによりよい医療を還元できる時期が早まりますので。そうは言っても、取り出した直後に凍結させた組織検体でなくてはならず、状態のよい検体を集めるのが難しいところでもあります。

吉田: 最初の苦労は研究班の中での共通言語がないことでした。私は大学院生のときから研究に参加させていただいています。そのころはまだCAGE法による候補遺伝子の抽出が終了した頃で、これからどの候補が最もよいバイオマーカーになるかの検証を開始する時でした。当初は、目標は同じであっても臨床医と研究者の先生の間に共通言語がなく、苦労しました。そもそも私たちも「CAGEって何?」というところからスタートしましたので、何度も話しあい、ディスカッションを繰り返し、徐々に同じ言語で話せるようになりました。いろいろな分野の方々が関わっている研究なので、患者さんの声、臨床の先生方の声、理研の研究者視点のご意見もいただきながら、少しずつ軌道修正して進めてきました。臨床サイドと研究サイド、どちらか一方に力が偏ると方向性を間違えがちですが、豊富なコミュニケーションでいい関係を維持し良い方向に進んで来ることができましたね。

寺尾: 一般的に、臨床の先生と基礎研究の先生はあまり交流がありませんよね。このようなトランスレーションリサーチではどんどん人の輪が広がる一方で、研究を進める中でさまざまな問題も生じます。それぞれの間に立ち、橋渡し役をしてくれたのが吉田先生。吉田先生がいないとどうにもなりませんでしたね(笑)。
吉田: 臨床だけに携わっていたら出会わなかった方々と研究や仕事をさせていただきましたし、人の輪が広がったことは私の最大の財産です。現在はロシアの研究機関ともパイプができ、次の研究の種も芽吹いてきています。
伊藤: 私もこのプロジェクトがなければ、お医者さんと仕事をすることはありませんでした。実際、生きている人の細胞組織を扱う機会は、病院と組まないとありえないですね。培養細胞ならいくらでもできるのですが。研究の成果として、医療に還元でき、患者さんに喜んでいただけるのは、普通に基礎研究をしていたらほぼほぼありません。こうした機会をいただき本当に感謝しています。
それから、私は研究者なので「ニーズ」をご提供いただけることが非常にありがたいです。「ニーズ」というのは、開発側から見れば「課題」。先ほど、2~3時間かかる工程を30分で...というお話がありましたが、そういう「課題」をいただけると私たち開発側は非常にモチベーションがあがります。課題さえあれば、そこに向かって邁進し、万難を排して解決することができますから。
 また、順天堂の先生方は「こうじゃないと使わない」とはっきり言ってくださいます。具体的なハードルを設けてもらえれば、飛び越えるのはそんなに難しい話ではないんです。むしろハードルがない方が難しい。どれだけ跳び上がればいいのかわかりませんから(笑)。
また、順天堂の先生方は「こうじゃないと使わない」とはっきり言ってくださいます。具体的なハードルを設けてもらえれば、飛び越えるのはそんなに難しい話ではないんです。むしろハードルがない方が難しい。どれだけ跳び上がればいいのかわかりませんから(笑)。
寺尾: 私たち臨床の「ニーズ」を理研の先生方にサポートしていただけるのは大変心強いです。同時に、私たちも理研の先生方の「シーズ」をいかに有効に臨床に還元できるかがこのプロジェクトの意義ですね。
今後は私たちが発見したバイオマーカーを臨床応用して、患者さんごとに適切な個別化医療を実現するのが目標です。私たちの手法が日本発で世界へひろがり、患者さんのQOLを上げ、臨床医の負担を減らすことができれば、これ以上の喜びはありません。またなによりこの研究にご理解をいただき、組織検体提供にご協力いただいている多くの患者さんに深い感謝の気持ちをお伝えしたいです。患者さんのご協力なしでは私たちの研究は進みませんから。さらにプロジェクトでは順天堂以外の医療機関にも多大なご協力をいただいています。また、国立研究開発法人日本医療研究開発機構(AMED)や文部科学省の科研費からも支援もいただいており大変感謝しております。

この子宮体がんにおける共同プロジェクトは"臨床医の現場の願い"からスタートしましたが、理研の基礎研究との出会いで光明をみいだし、さまざまな課題を乗りこえてようやく医療技術としての輪郭が見えてきました。この熱い流れを加速して一日でもはやい実用化を目指し、成果を社会に還元できるよう、順天堂・理研の先生方、共同研究施設、提携医療機関、支援部門の関係者含め全員で力を合わせて、これからもプロジェクトを推進してまいります。

寺尾泰久
1996年、順天堂大学医学部卒業。順天堂医院にて臨床研修医。1998年、順天堂大学大学院医学研究科博士課程入学後、九州大学生体防御医学研究所へ国内留学。2002年、順天堂大学で博士課程を修了後、同大産科婦人科学助手。2003年に米国イリノイ大学へ留学し帰国後は順天堂大学産科婦人科学で助手、臨床講師、医局長、准教授、先任准教授を勤め2020年より同教授。(インタビュー当時は先任准教授)

吉田惠美子
2003年、昭和薬科大学薬学部卒業。2004年、滋賀医科大学医学部学士編入。2011年、滋賀医科大学医学部附属病院で臨床研修修了後、同年より順天堂大学産婦人科学講座助手。越谷市立病院産婦人科、順天堂大学医学部附属静岡病院産婦人科助手を経て2014年、順天堂大学大学院医学研究科博士課程入学。2015年、理化学研究所ジュニアリサーチアソシエイト兼任。2018年、博士課程を修了し産婦人科学講座助教、難病の診断と治療研究センター博士研究員、理化学研究所客員研究員兼任。

伊藤 昌可
1990年、岐阜大学農学部卒業。岐阜大学大学院連合農学研究科博士課程修了後、農林水産省食品総合研究所を経て理化学研究所へ。1998年、理化学研究所基礎科学特別研究員。2001年、同研究所研究員。2008年、同研究所専任研究員。2013年、同研究所コーディネーター。2018年、順天堂大学大学院医学研究科臨床オミックス研究コース客員教授。




